康乃德生物医药推进抗体新药CBP-201进入澳洲临床开发
2018年4月24日,中国苏州,太仓——康乃德生物医药有限公司今天宣布,公司已在澳大利亚递交申请,开始第一阶段临床试验,评估公司对过敏性炎症的候选单克隆抗体CBP-201。
CBP-201临床I期试验是一项在健康受试者中进行的随机、双盲、安慰剂对照的研究,以评估其安全性、耐受性、药代动力学(PK)和药效学(PD),至少有40名健康受试者将参加此次单剂量递增研究。

“我们非常激动地启动CBP-201首次人体研究。CBP-201是一种新型、高效的抗白细胞介素-4受体α(IL-4Rα)的单克隆抗体。IL-4Rα是一种经临床验证的调节IL-4和IL-13生物活性靶点,IL-4和IL-13是驱动各种过敏性炎症性疾病的两种关键细胞因子。”康乃德生物医药首席医务官Jeffery White博士表示,“临床前研究表明,CBP-201与目前临床开发中的IL-4Rα抗体相比,药效更高,药代动力学特性更好。通过使用验证的生物标记物,我们预计临床I期试验将提供重要的安全性、PK和PD数据,以支持CBP-201在患者中继续进行临床试验。”
康乃德首席执行官郑伟博士表示:“我们非常高兴康乃德再次将高质量、内部发现的候选药物推向临床研究。CBP-201的进展进一步验证了我们高效的运营策略:将我们在T细胞调节方面的专业知识与高质量CRO高效合作相结合,为炎症性疾病提供新的治疗方法,满足中国和全球性的需求。”

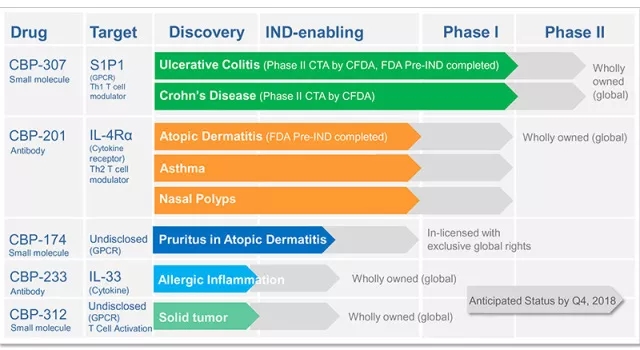
康乃德主要的候选药物CBP-307是一种可口服的新一代S1P1和S1P5(G蛋白偶联受体-GPCR)调节剂,可治疗诸多自身免疫性疾病,包括炎症性肠病、牛皮癣、多发性硬化症等。我们已经在澳大利亚墨尔本完成了临床Ⅰ期的随机、双盲、安慰剂对照研究,评估了CBP-307的耐受性、药代动力学和药效学特性。CBP-307表现出优良的安全性和强大的T细胞调节活性以及上佳的药物动力学和药效学性能,表现了“同类最佳”的潜力。CBP-307正在进入溃疡性结肠炎和克罗恩病的临床Ⅱ期研究。
第二个候选药物CBP-201是一种以IL-4Rα为靶点的抗体,可阻断过敏性炎症的中枢通路,并将用于针对变应性皮炎、哮喘和其他炎症治疗的临床研究。其他项目包括CBP-174、CBP-233和CBP-312。
CBP-201临床I期试验是一项在健康受试者中进行的随机、双盲、安慰剂对照的研究,以评估其安全性、耐受性、药代动力学(PK)和药效学(PD),至少有40名健康受试者将参加此次单剂量递增研究。

康乃德首席执行官郑伟博士表示:“我们非常高兴康乃德再次将高质量、内部发现的候选药物推向临床研究。CBP-201的进展进一步验证了我们高效的运营策略:将我们在T细胞调节方面的专业知识与高质量CRO高效合作相结合,为炎症性疾病提供新的治疗方法,满足中国和全球性的需求。”
康乃德
康乃德生物医药是立足于中国的,具有全球权益临床阶段产品的新药创新公司。此前,获得过凯风创投的天使轮投资。康乃德专注于发现和开发新型免疫调节剂,治疗自身免疫性疾病和炎症。我们拥有基于T细胞生物学功能的独特新药研发技术平台,帮助康乃德有效获得针对已有临床验证疾病通路靶点的新药分子。
第二个候选药物CBP-201是一种以IL-4Rα为靶点的抗体,可阻断过敏性炎症的中枢通路,并将用于针对变应性皮炎、哮喘和其他炎症治疗的临床研究。其他项目包括CBP-174、CBP-233和CBP-312。
