丹望医疗创始团队专访:类器官最需要解决的是标准化和自动化|凯风生态
凯风创投天使轮领投企业丹望医疗专注于肿瘤精准诊断和治疗领域,致力于类器官技术的临床开发和应用,为临床患者提供个性的精准化治疗方案。随着医药科研技术的不断高质量发展,被喻为“患者替身”的类器官越来越受到科学界和产业界的关注。未来,丹望医疗将通过缩短药研周期来降低药研成本,积极解决类器官标准化、自动化问题,建立高标准的 “实验室患者” 类器官库。
本文来源于生辉对丹望医疗创始团队的采访
北京时间 2021 年 6 月 17 日,神舟十二号载人飞船成功发射,在为期 3 个月的太空作业中,除设备调试、人体生理特征记录、日常管理等活动,三位宇航员还将在太空开展 9 项生物和医学领域科学实验或技术试验,“太空肿瘤:来自个体内健康和肿瘤组织的 3D 类器官培养物由于空间条件导致的早期突变特征研究” 就是其中之一。
此次同 “游” 太空的类器官,被外界形象地称为 “第四位宇航员”,类器官也因此再次受到科学界和产业界的关注。
类器官,是指利用人体干细胞或从病人身上提取的肿瘤组织,在特定的 3D 体外微环境中培养而成的,高度模拟人体器官特征的小型化体外器官模型。其最早的研究可追溯到 1907 年,但飞速发展是在近 10 年。2009 年,Hans Clevers 实验室使用单个 LGR5 + 肠干细胞在体外自组织成具有肠隐窝 - 绒毛结构的肠类器官,这是首个体外自组织的微型器官。也因此,Hans Clevers 被誉为 “国际类器官鼻祖”。
近日,Hans Clevers 等丹望医疗创始团队成员接受了生辉的采访,对类器官研究与产业化的现状以及未来发展等问题进行探讨。
复刻人体环境,新一代药筛模型
过去几十年常用的肿瘤药物筛选模型主要是 2D 细胞和人源化小鼠模型,但二者都存在一定的局限性。2D 细胞模型虽然可以在体外进行扩增,但是与人体差异较大,且传代后的细胞会丧失肿瘤异质性。而用人源化小鼠模型进行药物的筛选成功率较低,测试周期也较长,不具备高通量使用的优势。相比来说,类器官可以很大程度上模拟目标组织或器官的遗传特征和表观特征,并且稳定、容易扩增,具备了高通量运行的条件。目前,类器官已成为疾病研究、新药开发领域最受瞩目的模型。
Hans Clevers说,“我和药企合作已有十多年的经验,从药企的角度看,如果想用减半的投入,使药物研发量、研发速度翻倍,必须尝试与之前完全不同的东西,更加真实的人源模型 —— 类器官就可以满足这些需求。”
Hans 提到,国际上已发表的研究结果显示,在类器官上进行的药物测试和人体内数据一致性可达到 80% 甚至 100%。

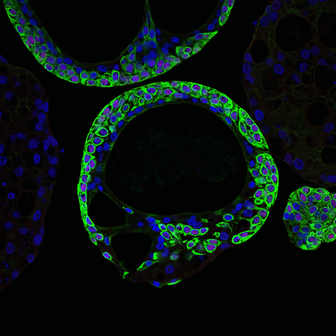
图|健康肠类器官荧光图(来源:受访者)
在药物开发早期阶段,类器官正在逐步取代传统模型。Hans Clevers 说,“我们做了十几年的类器官研究,发现很多患者的肿瘤样本都能培养成为长期培养的类器官,并且患者来源的类器官表型特征与原发肿瘤高度一致,也保留着很强的肿瘤异质性。相比于目前肿瘤药物研发中常用的 2D 细胞或 PDX 模型,类器官模型的肿瘤异质性或许更能接近患者的真实情况,为高通量筛选新的治疗靶点和药物提供了可能。”
在新药开发的临床阶段,可在类器官上开展与临床试验同步的大量、多角度的测试,为后续药物的开发提供一手数据,这在人体上是不可能实现的。Hans Clevers 提到,“可以通过类器官为同一个患者建立不同的类器官克隆,并分析其变化规律和药物反应差异。尤其是耐药机制产生的原因,对药物研发具有巨大价值。”
“其实新药研发早期失败的很大一部分原因就在于临床前模型和人体数据不一致,类器官或许可以弥补这一遗憾;同时,我们也可以通过多维度的测试了解疾病的机制,为靶点开发提供思路。” 丹望医疗 CTO 华国强补充说,“目前我们正在对此进行测试,从前期结果看,小分子药物、大分子药物,或是细胞治疗、基因治疗,在类器官上都可以很好地适用。”
类器官能够在体外 “再现” 体内组织的功能,就可以在实验室内模拟患者对药物的反应。这相当于在药物进入人体前,可以先在与人体内相似的类器官上进行提前试药,以找到对该患者的最佳治疗方案。因此类器官被形象地称为患者的 “替身”,这一特性也为类器官打开了肿瘤精准治疗领域的大门。
在过去十年,基于 biomarker 对肿瘤患者进行区分从而给予用药指导是肿瘤精准治疗的一大思路。目前,biomarker 的发掘主要依赖于基因检测等技术,通过基因分析预测表型。但其实,从基因型到表型之间存在许多未知。“类器官提供了一个功能性的验证平台,我们可以把药物在体内的反应机制想象成一个‘黑盒子’,我们把药物输入到类器官这个黑盒子,它输出机体对药物的反应,这很直观。这样不仅可以用来检测靶向药物,也可以用来检测化疗药物,甚至免疫药物和抗血管药也是可以的”,丹望医疗 CEO 李俊强说道。
可以说,类器官技术的临床应用场景覆盖了早中期癌症患者的新辅助治疗和术后辅助治疗、以及对晚期患者用药选择的指导。2019 年,丹望团队曾在国际顶级期刊 Cell Stem Cell 上发表类器官样本的临床试验结果,数据显示总体敏感性 78.1%,特异性为 84.43%。干细胞生物学家、斯坦福大学教授 Calvin Kuo 评论该研究 “为精准医疗的新范式铺平了道路”。
“类器官与体内组织具有很高相似度,以此为基础的功能性药物检测将为患者提供更精准的伴随诊断结果,推动患者个性化精准用药步入 NGD (Next Generation Diagnostics) 时代。”Hans Clevers 教授说道。
无论用于药物筛选还是精准医疗,类器官与人体组织的高度相似是前提条件,其稳定性和可扩增性也是必不可少的性质。Hans Clevers 说,“一旦你找到了合适的培养条件和体系,他们将永不停息的生长,而且长得更快。像消化道组织,尤其是肠癌、胃癌、胰腺癌等类器官的成功率很高,我们实验室有很多肠癌类器官已经生长了数年。” 这也使类器官的产业化成为可能。
随着类器官越来越多地应用于科研和药研中,产业化也是自然而然的事情。
“对我而言,我想找科研做得好、非常懂类器官技术,同时又有商业计划的合作者。” 在 Hans 看来,华国强和李俊强正是这样的组合,于是 Hans 将他们锁定为他工业界探索初体验的伙伴,一起迈上类器官产业化的道路。
其实,Hans 和华国强是旧相识,“华博士还在美国斯隆凯瑟琳研究所工作的时候,我们就有过合作,而且一直保持着联系和科研上的合作。”Hans 进一步介绍道,“3 年前,华博士联系我说想合作建立公司,刚好华博士和李俊强先生的组合是既了解科学研究,又懂商业推广的组合,是很好的合作者,所以我就同意了。”

现在,华国强除了丹望医疗创始人兼 CTO 的角色,也是复旦大学医学院教授。说起在纪念斯隆凯特琳癌症研究中心做博士后的那段经历,他表示,“那已经是 10 多年前的事情了。”
在过去的十多年里,华国强从正常肠道类器官研究到肠癌类器官的药敏测试,再到 2015 年回国在复旦大学医学院建立自己的独立课题组继续类器官研究,对类器官的基础研究、技术发展以及临床应用的了解不断深入,“确确实实感觉到了类器官模型能够解决目前临床和药物研究的很多痛点和瓶颈。” 他说,“回国建立最大的类器官库是我的梦想,也是我当年决定回国的重要原因。”
当时,身在美国纪念斯隆凯特琳癌种研究中心的华国强了解到,包括礼来、罗氏在内的很多 500 强药企已经开始布局类器官的应用。也正是这一信号,加快了华国强回国创业的步伐。
回国之后,在某种机遇下结识了拥有超过 20 年产业化和公司管理经验,且十分熟悉精准医疗领域的李俊强,二人一拍即合,认为类器官产业化已经到来。不久后,Hans Clecers 加入 “强强组合”,华国强的梦想以及丹望医疗的创办走上快车道。
今年 2 月,丹望医疗宣布完成数千万元天使轮融资。
目前,类器官的培养已经不再是首要的难题,从实验室研究到产业化应用,“类器官最需要解决的是标准化和自动化”。
丹望医疗也在这两方面努力着。李俊强提到,自动化方面,丹望医疗的类器官自动化铺板设备已经研发完成,原型机也已完成生产;标准化上,丹望医疗按照企业标准,对类器官临床试验的操作流程和关键质控点制定了相应的 SOP,且对每一个关键质控点的参数进行了明确。“这将大大减少类器官建立的人员投入,解决类器官复制问题。”
另外,新技术临床应用效果评价必须符合循证医学的要求,用临床数据说话。目前丹望医疗正在积极推动类器官临床试验的开展,已经在肠癌、胃癌、卵巢癌等肿瘤开展类器官平行临床研究。接下来,丹望医疗将逐步开展干预性的临床研究,甚至改变临床指南。
华国强表示,类器官作为患者 “替身”,建立一个肿瘤类器官模型就相当于在实验室复制了一个肿瘤患者,结合临床数据和药物敏感性数据,可以真正做到 “实验室患者 (Patient in the lab)” 活体数据库的建立。他进一步谈到,丹望正在布局建立高标准的 “实验室患者” 类器官库,希望依托多样化的 “实验室患者” 群体,发挥类器官模型在新药靶点发现和验证、转化研究、类器官临床试验(organoid trial)等方面的优势和潜力,真正解决目前生物医药方面的痛点和瓶颈。
对于类器官的未来,Hans Clevers 充满了期待,“类器官还有一个很大的应用领域是再生医学。未来我们会有结构更复杂的类器官,一些无法医治的患者可能会成为类器官移植的候选人,为再生医学提供有潜力的材料。”Hans 同时表示,“未来 5 年内,我们会看到类器官将替代动物模型进行毒性评估,2D 细胞系模型也将逐渐被代替。”